随着iPSC应用的增多,势必有越来越多的需求去建立标准化的克隆iPSC主细胞库(MCB)。Solentim公司的VIPS,CLD和ICON等设备组合使用Matriclone等新基质,可显著提高每板中iPSC 克隆的细胞活力,同时可提供其单克隆起源的影像证据,已在很多公司和科研单位得到使用和验证,建立了iPSC培养的新标准。
世纪之交发现的人多能干细胞(PSCs)为新一代再生医学研究打开了大门。在PSCs中,可用于诱导多能干细胞(iPSCs)的供体(donors)是最多的,能为所有类型的细胞治疗提供通用细胞(universal cell)的来源,其中就包括用NK细胞对癌症进行免疫治疗。与原代NK细胞不同,由iPSCs制备的NK细胞质量均一,也易于修饰来产生对肿瘤细胞所需的反应。目前已经有数种基因修饰和将iPSCs分化成NK细胞的方案,每种方案在免疫治疗方面都各有其优势。本篇综述中详细介绍了在NK细胞免疫治疗中使用iPSCs的好处,也讨论了此方法成为临床主流前必须克服的挑战。
关键词: 过继免疫治疗 (adoptive immunotherapy , AIT),定向分化,基因组编辑,诱导多能干细胞(induced pluripotent stem cells,iPSC),自然杀伤细胞 (natural killer cell, NK细胞)
前言
过继细胞移植(adoptive cell transfer,ACT)是对抗癌症的最新武器。这种疗法最初主要集中在T细胞上,因为T细胞对肿瘤细胞的反应强且毒性特异,还有高的扩增能力(Pericaet al.,2015)。自然杀伤(NK)细胞一样也有抗癌作用,但副作用却较轻,故而在ACT的应用中也作为选择 (Lee, 2019)。此外,通过基因工程也可以增强NK细胞的毒力,而且T细胞和NK细胞间还可以互补,比如肿瘤细胞对T细胞的一些免疫抑制机制如下调人白细胞抗原(HLA),已被证明是却是对NK细胞的刺激。
虽然最初基于NK细胞的ACT研究,使用的是外周血原代NK细胞(PB-NK),实际上在脐带血中(CB-NK)和在永生化的细胞系如NK-92中,NK细胞的含量更为丰富(10%对30%),也更容易进行基因修饰(Myers和Miller, 2021;Shankar等,2020)。在各种细胞类型中,干细胞在许多方面都最具优势。因此,科学家们开发出了干细胞扩增、基因修饰和分化为NK细胞的诸多方案。
在干细胞中,诱导多能干细胞(iPSCs)具有的许多特性,使其成为理想的起始来源。在本综述中,调研了用于ACT的由iPSCs产生的NK细胞(iPS-NK)在生产和基因工程方面的进展。
NK细胞
NK细胞是报道的第一种先天淋巴细胞(Kiesslinget al., 1975a; 1975b)。一般将CD3下调和CD56上调的淋巴细胞识别为NK细胞,这主要由IL-15信号调节。其细胞毒性依赖于对多种激活性和抑制性受体的刺激,以及穿孔素(perforin)和颗粒酶B(granzymeB)的分泌。激活性受体,比如有可触发抗体依赖的细胞毒性作用(ADCC)的CD16,以及能和靶细胞直接结合的天然细胞毒性受体(NCR)家族成员NKp30, NKp40, NKp44, NKp46和NKG2D等 (图1)。此外,NK细胞还能分泌一些细胞因子去激活其他免疫细胞(Shimasaki et al., 2020)。抑制性受体如NKG2A和杀伤免疫球蛋白样受体(KIR),一些配体如HLA可与之结合来抑制NK细胞,这能为自身细胞提供一种免受先天免疫的保护。因此,通过这些不同受体表达的刺激信号与抑制信号间的平衡,NK细胞表现出对靶细胞的应答或耐受。
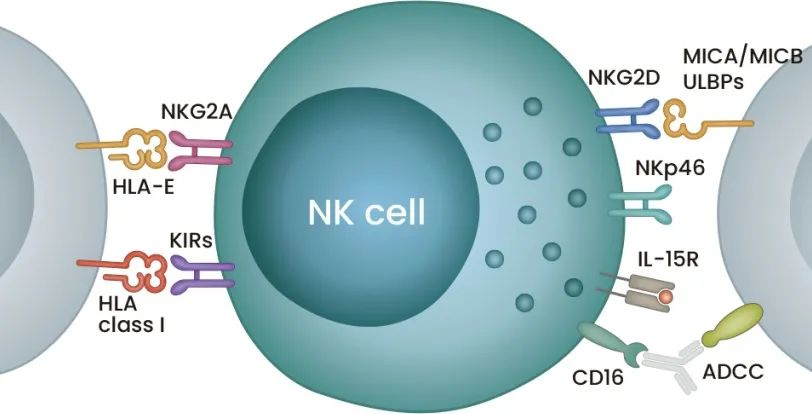
图1。一个NK细胞和主要的表面受体示意。中间的NK细胞分别在左侧和右侧表达一些主要的抑制性受体和激活性受体。旁边的细胞则是靶细胞。文中可见相关受体的详细信息。ULBPs, UL16-结合蛋白。
维持HLA I类分子的表达来激活抑制性受体KIR,一直是肿瘤细胞逃避NK细胞免疫监测的机制之一(Dianat-Moghadam et al., 2018)。其他机制包括上调HLA-E去激活NKG2A,或脱落MICA和MICB来抑制NKG2D。(拓澳编者注:MICA/B是同一类MHC I应激蛋白,在黑色素瘤、肺癌和白血病等癌细胞表面都有表达。NKG2D可以识别MICA/B,是目前为止在体内发现的唯一可识别MICA/B的受体,主要在NK细胞、NKT细胞、γσT细胞、CD8+T细胞表面表达,作为一种激活性受体介导以上免疫细胞活化进而杀伤靶细胞。)此外,通过分泌细胞因子TGF-β,阻断IL-15、IL10和免疫检查点抑制剂PD-1,也可促进免疫逃逸。与之对应,一些治疗措施则能克服这种免疫逃逸。例如用抗体阻止MICA和MICB的脱落,可通过对NKG2D刺激维持NK细胞对黑素瘤的反应(Ferrari de Andrade等人,2018)。其他如增强IL-15表达的方法也尤其值得关注。有文献显示,IL-15的表达可能是癌症复发风险的生物标志,而且表达有失活的TGF-β受体的NK细胞(拓澳编者注:预期无法再阻断IL-15)在胶质母细胞瘤模型中表现出了更高的细胞毒性效应(Mlecnik et al.,2014;Yvon et al.,2017)。最后,增强NK细胞活化、增殖和扩张的IL-15超激动剂(superagonists)已经应用于血液肿瘤和实体瘤的临床研究(Romee etal., 2018;Wrangle等人,2018年)。
总的来说,ACT中使用的各种类型的NK细胞均耐受性良好,可以持续存在和扩增,在一些患者亚群中可以导致完全缓解(Bachanova和miller, 2014)。产生耐受的原因之一是这些细胞在宿主体内接受了“再教育”(re-educated),从而维持了对非HLA表达细胞的致死反应,同时将移植物抗宿主病的风险降至最低。由于这一特点,同种异体的(allogeneic)NK细胞能有更多的可用供体来源,相比于T细胞免疫疗法,这是一个显著的优势(Ruggeri et al.,2002)。
但是从供体获得的PB-NK和CB-NK的数量还不足以进行ACT,都先需要进行体外扩增。可能是因为IL-2受体基因最早被克隆出来,一直以来不少体外扩增的方案都用这个细胞因子。然而,现在是首选的是IL-15。因为IL-15能高特异性地激活NK细胞,IL-2与其不同,其激活各种免疫细胞,包括可以抑制抗癌反应的调节性T细胞(Yang and Lundqvist, 2020)。尽管如此,IL-15刺激的最佳时机和剂量仍需要摸索,否则扩增出的NK细胞有分化为衰竭性表型的风险(Felices et al., 2018)。永生化细胞系NK-92则显示出与其他来源NK细胞类似的抗肿瘤作用,还具有能无限增殖的额外优势(Zhang et al., 2019),但其主要缺点是非整倍体(aneuploidy)和不稳定,在ACT之前必须接受辐射,这会抑制其在患者体内的增殖能力;此外,这些细胞不表达CD16,这也会阻止ADCC效应的产生。
另一种增强NK细胞活性的方法是基因修饰,但对PB-NK和CB-NK等增殖能力相对来说较低的细胞效果一般。相比之下,干细胞,不仅包括诱导多能干细胞(iPSCs),还包括胚胎干细胞(ESCs)和造血干细胞(HSCs),更容易做基因修饰。其中,iPSCs的干性(stemness)优于HSCs,可获得性(availability)优于ESCs。
供临床应用的iPSCs
iPSCs是经重新编程回到胚胎样状态的体细胞,理论上讲,任何类型的体细胞都可以被重编程。iPSCs则通常用一些容易获得的细胞如成纤维细胞和血细胞来制备。从临床应用的角度看,iPSCs的吸引力一是在于其高的扩增能力,来自单个供体的少量体细胞就能制备出大量的细胞。二是具备多能性,能分化成任何所需的细胞类型如NK细胞(Karagiannis et al.,2019)。这些特性都有利于去做安全性检测和质控,与需要胚胎供体的ESCs不同,iPSCs可有更广泛的供体群体,这简化了供体与患者的匹配(donor-patient matching)。第三,可以建立iPSC单个细胞起源的主细胞库(MCB)来储存细胞,为临床应用提供一种稳健的和可重复的起始细胞来源(图2)。最后,随着CRISPR/Cas等基因编辑技术和单细胞技术方面的进步,iPSC基因组编辑的流程也日趋简化(Woltjen et al ., 2016)。
目前,一些利用iPSCs包括iPS-NK的临床试验正在进行(Yamanaka, 2020年)。其中,第一个使用iPSC产品的住院试验是治疗年龄相关性黄斑变性:将自体成纤维细胞重编程成iPSCs,再分化成视网膜上皮细胞片,随后移植入患者的眼睛(Mandai等人,2017年)。由于使用的是自体细胞,预期对移植物的免疫反应可以降至最低。患者的随访也证实了这点,但移植用产品的准备时间和成本却非常可观,对有着进行性退行疾病的患者而言,可能等不起;对支付方(患者个人或医保)来说,也无法负担。
为了解决这些问题,科研工作者正在共同努力,比如去建立HLA-纯合和HLA-编辑的人iPSCs库。(拓澳编者注:细胞治疗的一个关键问题是免疫排斥反应。克服的方法之一是HLA单倍型匹配,这是目前广泛应用于造血干细胞移植的方法。即使用了HLA匹配,免疫抑制剂仍是需要的,不过可以减少免疫抑制的剂量和持续时间。iPSC可以从HLA单倍型捐赠者身上获得,通过与现有的生物库如骨髓库和脐带血库合作,可以有效地识别HLA纯合供体。一个国家或民族中罕见的单倍型可通过国际合作得到解决。随着基因编辑技术尤其是CRISPR技术的出现,还可以通过使HLA基因在多能干细胞中失活来克服免疫排斥,这种方法则被称为HLA掩蔽/Cloaking)。从免疫匹配的角度来看,这两种iPSCs库都是为了最大限度地增加患者可及性而设计的。为了收集HLA纯合的iPSCs,需要与血库和骨髓库合作招募捐献者(Umekage et al., 2019)。在日本,仅仅从10名纯合供体中制备出的最常见HLA的iPSCs就能匹配国内一半人口。但如要满足更大比例的人口,所需的数量却不是呈线性增长,预计需要75或140个HLA纯合子的超级供体细胞库才能分别满足80%或90%的人口需求(Okitaet al., 2011)。此外,日本的民族成分相对单一,其他国家可能需要多得多的数量。
对HLA-编辑的iPSCs库的研究,除了希望能减少所需谱系的数量外,还能推动制备出更有效的NK细胞用于ACT,因为这些研究中就包括抑制NK细胞的机制。敲除β-2微球蛋白(B2M)基因将消除所有HLA表达,也就消除了宿主T细胞对不匹配移植物的排斥反应。(拓澳编者注:所有的I类MHC,包括HLA-A、HLA-B和HLA-C,可通过删除其共同成分基因B2M而失活。同样,HLA-DP、HLA-DQ和HLA-DR的表达可通过删除对II类MHC基因转录激活因子来抑制,这种方法被称为HLACloaking。但是,缺乏I类MHC会被NK细胞裂解,这种现象被称为“缺乏自我表型识别”。NK细胞具有多种抑制性受体,例如NKG2A受体和KIR受体,利用配体激活这些受体会抑制裂解活性。I类MHC分子充当这些受体的配体,因此表达I类MHC的细胞不会受到NK细胞的攻击。相反,当I类MHC分子被“隐藏”时,这些细胞会被NK细胞靶向裂解。)但也正因于此,敲除B2M又让这些细胞暴露于宿主NK细胞的反应中。为了避免NK细胞激活,同时保持T细胞逃避,一个策略是引入由HLA-E和B2M组成的嵌合分子,或仅保留一个HLA-C等位基因(Gornalusse et al., 2017; Xu etal., 2019)。
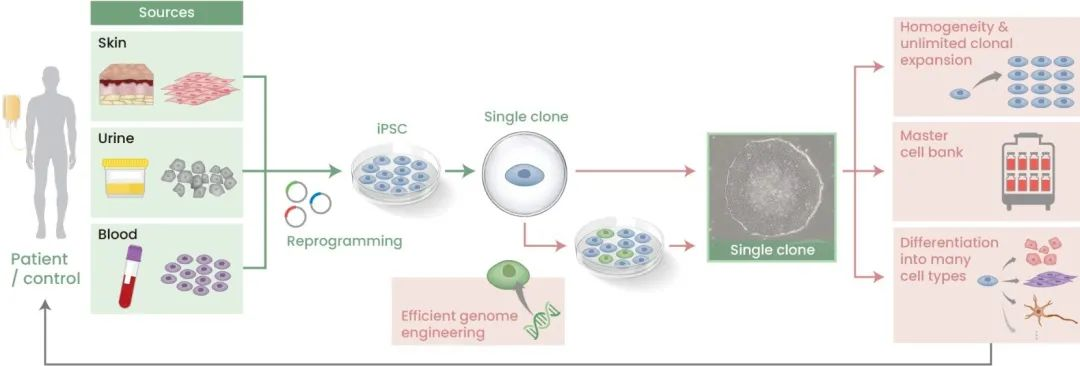
图2所示。iPSCs在再生医学中的应用。理论上,任何类型的体细胞都可以重编程成iPSC,但在实践中常使用容易获得的细胞,如来自皮肤、尿液或血液的细胞。将重编程因子转染到细胞中获得iPSC克隆后,选择一个单克隆予以无限和均一地扩增。新技术的进步则简化了iPSCs的基因组编辑流程,能够在克隆水平(绿色细胞)进行精确的基因修饰。扩增后的细胞可建立主细胞库,或分化为不同目的的特定细胞类型用于细胞治疗。
NK细胞的分化方法
iPS-NK分化培养的方法有2D和3D两种。两种方法都能诱导造血干细胞分化,并经造血祖细胞(HPC)阶段最终获得NK细胞。滋养层细胞培养系统(Feeder systems)有着较高的分化效率,适合于基础研究,但在临床研究时却不适合。可以想见大规模的生产需要非常多的滋养细胞,这不仅会增加成本,在工艺的各个步骤中也要有更多的安全测试。
人ESCs早在iPSCs出现的10年前就已被报道,故而有几种iPS-NK的分化方法其实都是沿用ESCs的方法。最早,Kauffman组使用两步体外2D分化法:先共培养人ESCs和小鼠骨髓基质细胞(stromal cells),促进造血分化;随后,将分选出的HPCs和第二种基质细胞共培养,同时加入细胞因子“鸡尾酒”(包括IL-15 IL-3, IL-7和Flt3L),最后得到ESC来源的NK细胞(ESC-NK)(图3,上)。ESC-NK具有良好的功能特性,可以产生细胞因子,具备杀伤活性,能在体内和体外杀伤肿瘤细胞(Wollet al.,2005;2009)。其他研究组则用表达有Notch配体DLL1或DLL4的基因工程滋养细胞替代上述第二种基质细胞,可以促进HPCs向NK谱系方向分化和扩增(Mesquittaet al.,2019;Zeng et al.,2017)。
当iPSCs在无滋养层的低吸附板中悬浮培养时,会自发形成称为胚状体(EB)的聚集物。胚状体中的细胞可在外源细胞因子的作用下生长,并向特定的细胞系分化。然而,EBs大小不一,这会影响分化的可重复性,故而难以满足GMP (Good Manufacturing Practice)的要求。Spin-EBs则是解决这个问题的方法之一。离心已知数目的iPSCs产生大小一致的EBs,可以让分化更有一致性也更为有效。Kauffman组应用spin-EBs在无滋养条件下生成iPS-NK,无需做细胞分选,该方法采用的相关条件和系统可以完全界定,适合于临床应用(Knorr等,2013)。并且,这些iPS-NK具有与有基质细胞时得到的iPS-NK相似的基因型和表型。但尽管很精妙,该方法却有着专利的限制,这也刺激了人们去开发一些替代的其他3D方法。Kaneko组就报道了一种规避spin-EBs的方法。EBs诱导造血分化后,他们将得到的HPCs在FcDLL-4 (一种重组有人IgG Fc段的嵌合蛋白)中培养,无需基质细胞,加入一种T细胞分化所需的细胞因子“鸡尾酒”,产生淋巴细胞祖细胞,随后加入phytohemagglutinin-P进行扩增 (Ueda et al., 2020) 。值得注意的是,这项研究并没有产生iPS-NK,而是报道的NK/固有(NK/innate)淋巴细胞,其在小鼠模型中表现出对实体瘤的有效细胞毒性并延长了小鼠寿命。未来的工作将探索对细胞因子鸡尾酒的调整能否可以产生纯的iPS-NK。另一个可促进EB建立iPS-NK的方法,是加入HOXB4同源蛋白。HOXB4是HSC自我更新和扩增的重要调节蛋白。事实上,一项研究发现,在HOXB4上培养EB分离出的HPCs可促进其扩增(图3,下)(Larbi et al.,2012)。相信对该机制的进一步研究,将有助于识别出具有相同效果并满足GMP要求的小分子。因为通常来说,小分子可以降低产品开发的成本,同时可保持甚至提高NK细胞的分化效率。例如Slukvin研究组就发现,UM171(一种HSC-激动剂,嘧啶酮-吲哚衍生物)可选择性地促进淋巴祖细胞群的扩增,具有10倍向NK细胞分化的倾向性 (Mesquittaet al.,2019)。
NK细胞在癌症免疫中的作用还有一个方面是其间接的细胞毒性。NK细胞可以激活其他几种免疫细胞,如B细胞、T细胞、巨噬细胞、树突状细胞和中性粒细胞(Vivier et al., 2011)。Cichocki等人(2020)证明了iPS-NK也具有这方面的功能,他们发现iPS-NK能够招募T细胞到肿瘤部位,并且当两种细胞与抗PD -1抗体结合时,都能发挥细胞毒性。这些发现显示,通过招募其他免疫细胞到肿瘤部位,基于iPS-NK的ACT对异质肿瘤(heterogeneoustumors)也有效。
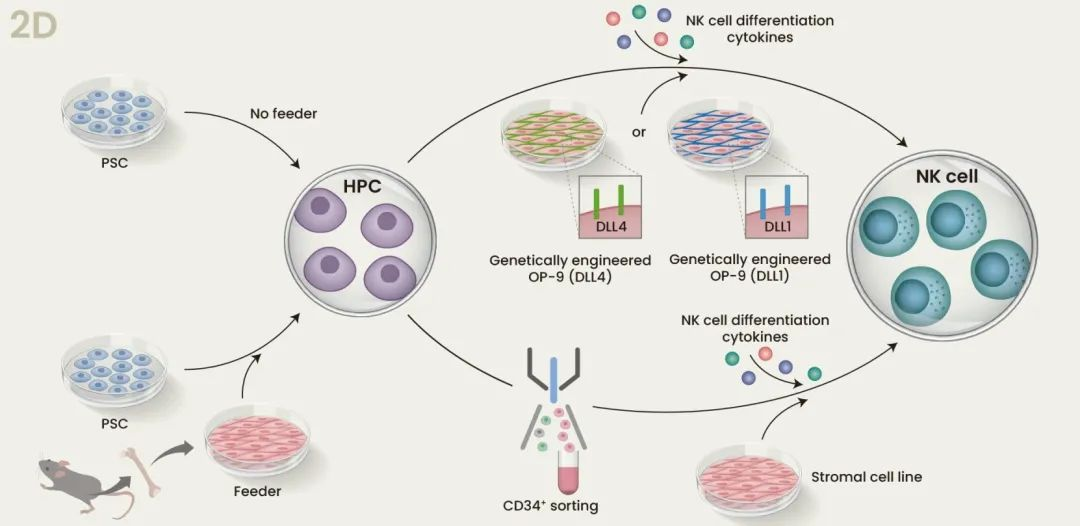
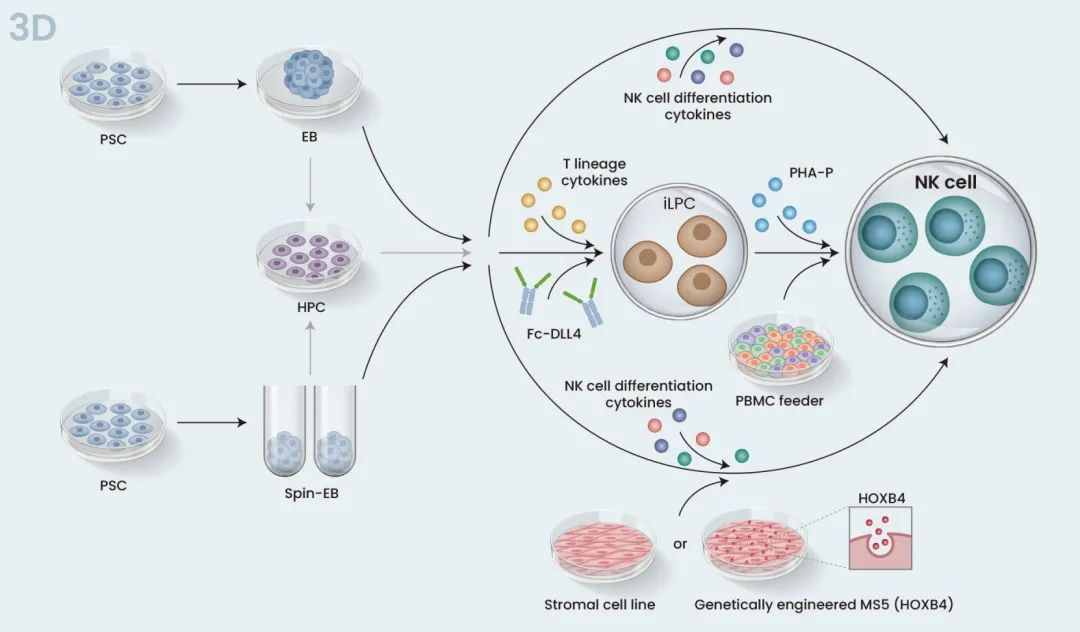
图3所示。iPSC向NK细胞分化的2D和3D方案示意图。2D法和3D法都分为两步。先将PSCs分化为HPCs,随后将HPCs与诱导NK细胞分化的细胞因子混合培养。在2D方案中(上),PSCs与小鼠骨髓基质细胞(滋养层)共培养以促进造血分化;接下来,分选出CD34+ HPCs 转移到第二种基质细胞系;或者不分选,将细胞转移到基质细胞系如OP-9,该细胞系设计表达DLL4或DLL1;两种情况中,都加入IL-15等细胞因子促进NK细胞分化。在3D方案中(下),HPC通过EB或Spin-EB悬浮培养进行分化。将EBs直接转移到滋养层基质细胞系,或在无滋养层基质的条件下将HPCs从EBs中分离并转移。两种情况下,也都加入细胞因子诱导NK细胞分化。iLPC, iPSC-derived lymphocyteprogenitor cells (iPSC来源的淋巴细胞祖细胞); PHA-Pphytohemagglutinin-P; PBMC,外周血单核细胞。
NK细胞基因工程
嵌合抗原受体(CAR)是一种合成的受体,基因修饰后表达CAR的免疫细胞可以特异性地追踪和识别并杀伤肿瘤细胞。首个获批的CAR疗法,axicabtagene ciloleuel和tisagenlecucel,是该技术迄今为止最大的临床里程碑。这些依靠自体T细胞治疗血液系统恶性肿瘤的疗法有显著的应答率,可高达90% (Maude et al., 2014)。然而,仍有不少问题阻碍着CAR-T细胞治疗成为主流。最有压力的可能就是成本,个人和社会的负担沉重。此外,危及生命的细胞因子释放综合征(CRS)和神经毒性也很常见,其中CRS的原因之一是IL-6,但NK细胞不分泌这个因子,因此在这方面NK细胞应该更安全(Ueda和Kaneko,2020)。并且CAR这个方法也与NK细胞兼容,目前有近20个CAR-NK的临床试验正在进行中,其中包括一个CAR-iPS-NK的试验(Imai et al.,2005;Xie et al.,2020)。
CAR由胞外单链可变区片段(scFv)和胞内免疫细胞激活域组成(Sadelain et al., 2013),后来人们在设计中又加入了共刺激域。以CAR-T为范例,最初在NK细胞中插入了4-1BB共刺激域,能有更好的持久性; 进而,采用一种NK细胞特异性的共刺激域2B4,可以通过多种方式改善细胞的功能,包括增强细胞毒性、增殖、细胞因子分泌和持久性(Xu et al., 2019b)。使用iPS-NK, Kaufman组比较了11种具有不同NK细胞特异性结构域的CAR。他们发现,与2B4一起,NGK2D跨膜结构域导致了对卵巢癌异种移植模型的最佳反应(Li et al.,2018)。值得注意的是,这并不适用于所有包含这两个结构域的CAR,这反映出如何最好地设计CAR仍然存在许多问题。此外,使用PB-NK的CAR实验表明,不同细胞亚群对CAR刺激的反应也不同,分化成熟的NK细胞能表现出最佳反应(Oei et al., 2018)。但这一观察结果只测试了抗-CD19外结构域,至于哪些亚群对其他外结构域的修饰反应最好,则需要进一步的研究。可见在这点上iPSCs又独具优势,因为可以产生多个NK亚群去进行优化。
将IL-15信号纳入CAR有利于抗肿瘤反应。Rezvani组对CB-NK进行基因修饰,使其分泌IL-15对CD19+细胞作出反应(Liuet al., 2018)。IL-15的加入显著增强了细胞的持久性,产生了更强的抗肿瘤活性。基因修饰还包括一个半胱氨酸蛋白酶(caspase)基因,可被一个小分子中被激活。这些细胞目前都正在进行临床试验,研究人员也已将细胞来源转向iPS-NK,并启动了iPS-NK的临床试验(Liu et al.,2020)。
虽然不是CAR,其他基因修饰也可以通过维持IL-15让 iPS-NK有更强的抗肿瘤作用。细胞因子诱导含sh2蛋白(CIS)是IL-15信号传导的负调控因子,在小鼠中,缺失其编码基因Cish,可使NK细胞存活率和细胞毒性提高,产生对几种癌症的抵抗力(Delconte et al.,2016)。Kaufman团队在NK细胞分化之前删除iPSCs细胞中的Cish基因,证实具有相同的效果(Zhu et al., 2020a),细胞糖酵解(glycolysis)和线粒体呼吸(mitochondria respiration)等代谢健康(metabolic fitness)显著改善。对肿瘤微环境的代谢反应是免疫细胞抗肿瘤作用的关键决定因素(Wegiel et al.,2018)。有趣的是,IL-15的敏感性仅在较低浓度时表现出增强:在浓度为1 ng/ml时,CISH-KOiPSC-NK的功能高于野生型iPSC-NK,但在10 ng/ml时没有差异。此外该研究还发现,在NK细胞中,以10 ng/ml剂量延长IL-15治疗会伴随某种程度的耗竭和更低的线粒体呼吸。如前所述,较低的剂量可能在临床应用中具有重要意义,而长期暴露于IL-15则可能导致耗竭。
CD16作为一种IgG Fc受体,能够触发细胞的杀伤效应,允许NK细胞介导ADCC,是NK细胞最有效的激活受体。其在细胞表面的表达受ADAM17(一种崩解素和金属蛋白酶-17)的调节,在NK细胞激活时或处于肿瘤微环境时,对受体进行切割(Romee etal ., 2013)。NK-92不表达CD16,故无法进行ADCC,但一些研究小组已经成功地转导入CD16基因(Mantesso et al., 2020)。在iPSCs中表达抗剪切CD16时,产生的iPS-NK对多种肿瘤有更强的ADCC作用 (Zhu et al.,2020b)。然而,就像延长IL-15的暴露时间一样,简单延长CD16表达的时间实际上可能对NK细胞的攻击能力也是有害的,因为受体切割是令NK细胞从目标细胞分离再去攻击其他细胞的关键。事实上,附着时间的延长可能也会减少穿孔素的分泌,降低抗肿瘤的反应(Srpan et al., 2018)。
最后说一下关于CD38的基因修饰。Daratumumab是一种单克隆抗体,可显著改善多发性骨髓瘤的预后,但大多数患者的反应却是短暂的。原因之一是与靶细胞一样,NK细胞也表达CD38,从而对抗体也敏感。因此接受Daratumumab治疗的患者很快会耗尽NK细胞,ADCC也会降低。为了保护患者的细胞,研究人员用CRISPR-Cas9 敲除原代NK细胞中的CD38(Naeimi Kararoudi et al., 2020)。正如预期,这种策略维持了NK细胞数量,恢复了ADCC。由于CRISPR-Cas9编辑系统在iPSCs中具有更高的效率,我们预计在这方面iPS-NK的应用前景尤其广阔。
结论
随着基于CAR和iPSC的治疗疗法在临床上的成功,让人们对把这些技术转化到NK细胞的新癌症免疫疗法充满了期待。因为与T细胞相比,NK细胞提供了一种潜在的更安全但同样有效的治疗方法,而且供体来源的种类也更多,HLA不匹配并不像对T细胞时是个大的问题。随着分化方法的完善,iPS-NK最终有望在所有表型中与PB-NK相同,包括在肿瘤环境中受体表达,和相应的扩增性、持久性和细胞毒性。此外,iPSCs基因工程的相对简单可让生产出的CAR iPS-NK具有所需的特性,如更高的持久性和靶向特异性,抗耗竭的稳健性,以及激活其他免疫细胞以增强对肿瘤的攻击。最后,发展iPSC库将加速向更广泛的人口提供iPS-NK,并提供具有质量一致性的产品。(致谢和参考文献等略,请点击“阅读原文”查询。)
