“由于尚难以建立稳定的生产细胞株,行业目前仍依赖于瞬时转染方法,而从贴壁到悬浮培养的转变已经在进行中。”
本文编译自genengnews,文章针对新一代病毒载体的生产工艺采访了来自Solentim, ThermoFisher,Catalent,Vigene,Sartorius和MilliporeSigma的六位研究人员,分别针对可放大的宿主细胞株、产量的挑战、专有细胞系、病毒的纯化和分析、新的生产平台和单克隆性证据的金标等六个议题发表了各自独到的见解和介绍。

尽管病毒载体在递送基因载荷方面的能力突出,在多种疾病(包括代谢、心血管、肌肉、血液、眼科、传染病和癌症)的治疗上也有着难以想象的前景,但还是有很多问题需要解决,尤其是在生产环节中。
由于其复杂性,病毒载体的生产工艺仍在发展之中。专家们一致认为,病毒载体(包含所需基因载荷的功能性衣壳)的总体产量是最大的障碍。目前广泛使用的瞬转,其实是创建一个一次性的“细胞工厂”,每次生产都需要有一个细胞株。如果能有一个稳定和优化的生产细胞株就像生产其他生物制剂时那样,就可以建立一个更稳健的生产工艺;此外细胞如果能悬浮生长,则该工艺还可以放大。
尽管已有了一些进展,但建立标准化流程的新技术和方法仍有待开发和实施,特别是流程中要涉及到GMP级的试剂时。为了加快进度,开发人员正在应用新的方法和工具,本文将介绍该领域中的六位开发人员,他们针对各自擅长的环节都有自己独到的见解。
可放大的宿主细胞株(Scalable host cell lines)
比起传统的重组蛋白,病毒载体则要复杂得多。病毒载体既有蛋白质又有核酸,因此在生产上面临着严峻的挑战。例如,病毒载体的生产过程通常要用脂质或聚合物的转染试剂和裂解缓冲液,而这些成分在重组蛋白的生产中则是不需要的。
根据Thermo Fisher Scientific细胞生物学主任Jonathan Zmuda博士的说法,病毒载体生产上的挑战涉及上游和下游。典型的挑战包括可放大性(scalability)、生产力保持方面的困难,并且从整体而言工艺缺乏稳健性(robustness)。
在可放大性方面,近年来取得了重大进展。但与CHO细胞相比,对用于大规模生产的HEK293细胞研究的还不是那么透彻。
相比之下,Sf9 (Spodoptera frugiperda)昆虫细胞用于1000-L或更大规模的腺相关病毒(AAV)生产已被充分验证,而且成本效益明显;但是昆虫细胞的生产系统有着许多常规实验室并不熟悉的工作流程和步骤,这让HEK293细胞的瞬时转染仍然是目前生产AAV最有效的方法。
“生产细胞株是任何病毒载体表达系统的基础,”Zmuda说。“我们必须非常非常的小心,要确保在开发的最初阶段筛选出合适的宿主细胞株。” HEK293T贴壁平台的缺点在于可放大性和需要用动物血清,而且有致癌性的大T抗原(large T antigen)对贴壁和悬浮的HEK293T平台都有影响。
为了解决AAV生产细胞株所面临的挑战,ThermoFisher研发了CTS病毒生产细胞(VPCs),在悬浮HEK293细胞中可放大地生产高滴度的慢病毒。最近推出的Viral Production Cells 2.0 (VPC 2.0)则是专门用于AAV的生产。VPCs2.0是一个经筛选得到的克隆HEK293细胞株,经GibcoAAV-MAX Helper-Free生产系统的瞬时转染后,支持在搅拌槽生物反应器中生产高滴度和高质量的AAV。
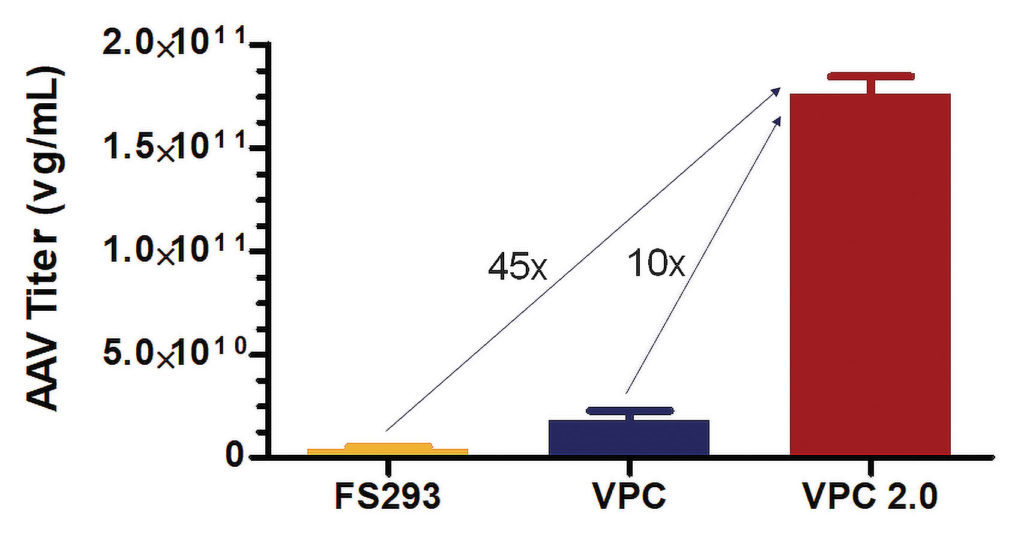
Thermo Fisher Scientific已经开发出了几种病毒生产细胞株。使用GibcoAAV-MAX Helper-Free AAV生产系统,对其中Freestyle293-F、VPCs和VPC2.0三种细胞株,使用GibcoAAV-MAX Helper-Free AAV生产系统,评估各自在悬浮培养中生产AAV的能力。VPCs2.0是一种293克隆性细胞株,其生产出的AAV滴度比FreeStyle293- F细胞和VPCs细胞分别高45倍和10倍。
对于需要病毒载体的基因治疗开发商而言,CDMO比如Thermo Fisher的相关服务是一个可行的选择。CDMOs通常具有工业规模的基因治疗流程的经验,并且具备可靠和高效的生产工艺。
产量的挑战(The yield challenge)
病毒载体生产的最大障碍是产量。所有细胞株都有影响载体生产的抑制序列(inhibitory sequences),而且关于病毒衣壳本身其实还有很多未知之处。举例而言,在不同的生产过程中病毒衣壳蛋白可能会经历不同的翻译后修饰。而一些关键的结构特征可能需要保留,以确保在体内的效力。
“如果产量能翻倍,成本就能降低一倍,”Catalent细胞和基因治疗业务部门产品开发全球主管Thomas VanCott博士说。Catalent是最早生产AAV载体的企业之一,也是第一个获FDA认证(FDA-licensed)的基因治疗产品的CDMO。

2020年8月,Catalent宣布其位于马里兰州Harmans的生产工厂已获得FDA批准,为脊肌萎缩症(SMA)的基因治疗生产所需的原料药。设施包括上图中所示的腺相关病毒(AAV)专用生产空间。Catalent称这是首个获批的基因治疗CDMO。
VanCott认为,仅靠开发者的自身能力,可能无法从细胞中制造出足够的AAV衣壳或功能性衣壳。复杂的转染过程也很困难,也需要优化,尽管该过程在某种程度上看着都差不多,但每个质粒系统还都有一点不同。此外,质粒DNA作为核心成分,也只有几家公司生产。
“仅这几个公司远远不能满足对质粒的需求,” VanCott断言。“为了保证开发时间,以及保证产品从研究级到GMP级具有一致性,我们已经在投资以将这种能力引入内部。比如,我们最近宣布收购了总部位于比利时的Delphi Genetics。”
在下游工艺中,功能性衣壳必须从空壳中分离出来。传统的超离方法效果不错,但费时又费力;有一些色谱技术表现得更好,比如使用连续流的工艺除了可以提高效率外,还可以改进分析方法来测量空壳和完整病毒的百分比。
VanCott强调说:“病毒载体必须是完整的,并且携带目标基因。” “我们的平台最小化了需要调整的参数,可以更快地确立工艺。其中一个关键点在于确保原材料的供应与交货时间”。诸如一次性生物反应器袋、培养基和其他用于生产的试剂等材料最近就比较难获得,因为COVID-19疫苗的生产也使用类似的物资,在供应链中享有优先权。
专有的细胞系(Proprietary cell lines)
对于基因治疗,递送基因主要靠AAV、腺病毒和慢病毒。生产商要有适合的细胞株来生产它们。Vigene Biosciences首席商务官Jeffrey Hung博士说:“理想情况下,应该使用稳定的细胞株来最小化批次间的差异。” “但是这类细胞株的产生和维持都非常困难,因为整合入细胞基因组中的病毒基因有着一些固有的毒性。”
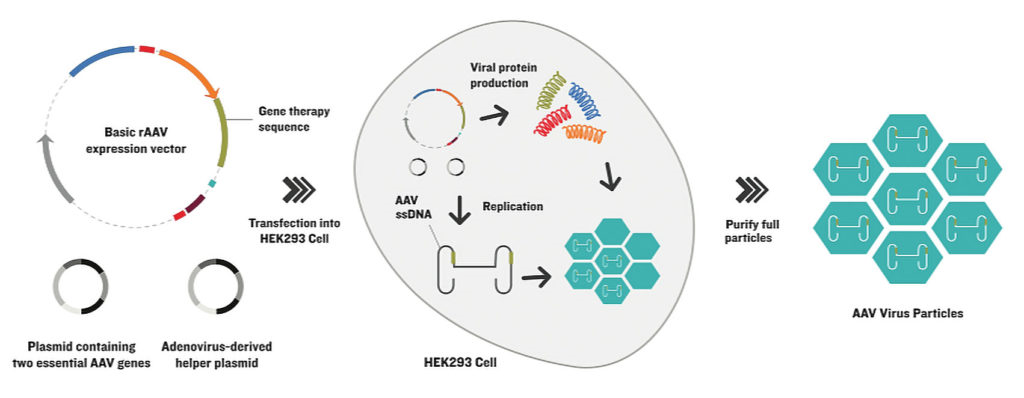
Vigene Biosciences用三质粒瞬转法生产重组腺相关病毒(rAAV)。如图中概述,该方法通过在一个质粒(左上)中引入基本的rAAV表达载体,在另外两个质粒中则引入其他的DNA(左下),消除了对辅助腺病毒的需要。质粒被转染到生产细胞株(中图),产生包含外源基因的成熟rAAV衣壳。经过纯化(右),这些病毒颗粒可以感染病人的细胞,递送DNA有效载荷,但病毒不能进一步复制。
Vigene已经开发了哺乳动物和昆虫细胞系,用于悬浮或贴壁培养的病毒生产。该公司指出,所采用的细胞系的特性(来源/起源、倍增时间,以及可以被病毒感染和复制)决定了病毒生产效率,而生长条件则决定了所需的下游加工方法和最终产品的放行测试。
由于昆虫细胞更小,在一个固定的体积内可以有更多的细胞,因而可提供较高的AAV产量。Vigene的昆虫细胞系技术使用杆状病毒表达系统在无血清条件下在Sf9细胞中产生AAV载体。然而,这并不是一个即插即用的技术。一旦AAV开始包装,杆状病毒就应被纯化去除。对于哺乳动物细胞如HeLa而言,则需要解决宿主细胞残留DNA的问题,可见不同细胞系都有各自的挑战。
“细胞系还有很多需要改进的地方,” Hung说。例如可以提供更好的包装效率和更大的稳定性,这样才可以解决与残留DNA相关的问题,还可以提高可制造性和可放大性。
Vigene Biosciences提供AAV、腺病毒、慢病毒和逆转录病毒的生产,还提供“从基础研究到推出商业产品的所有服务”。Hung补充说:“病毒载体只是我们提供的服务之一。” “我们的客户可以处于开发周期的任何阶段:从概念验证到中试,直到临床级的生产。对于已经生产了一些临床前级别产品的客户,他们会发现继续采用相同的细胞平台在生产的连续性上是有利的。”
纯化和分析(Purification and analysis)
工艺的优化并不容易,研究人员在上游要对培养和转染的条件做很多摸索。而到了下游,又面临着并没有一个标准的平台可以适用于不同的载体、血清型和表达系统。甚至还面临着一些非常具体的挑战,比如把空壳和完整AAV衣壳分开,或者对不同的血清型可能也要用不同的下游工艺。
各种复杂的分析方法和其所需达到的要求,还需要时间来建立。工艺需要在整体效率、产量、纯度和特性等方面体现出足够高产,以及通过工艺的稳健性来满足监管的要求,能在GMP生产中去除风险。
Sartorius Stedim Biotech公司病毒基础疗法市场进入策略主管Amélie Boulais Raveneau说:“我们已经在公司的高通量平台上投入了大量资金,比如用于细胞培养的Ambr平台和相关的实验软件设计。” “它们可以帮助企业用系统的方法去优化细胞培养和转染的相关参数。”
该公司最近收购了BIA separation,这让Sartorius的产品组合中增加了 “monoliths”整体柱,这类色谱柱具有独特的化学成分,允许高分辨率的AAV纯化。同时,Sartorius因此还获得了一个AVV工艺开发的实验室。

BIA Separations ,现在是Sartorius Stedim的子公司,开发了一种称为CIMmultus柱的整体柱(monolithic chromatography columns)。其特点是通过大流通通道(large flow-through channels)处理大分子蛋白、质粒DNA、病毒样颗粒和病毒(包括腺相关病毒),柱子通过对流(convection)来实现快速和低剪切力的物质传递。
Boulais Raveneau指出:“我们现在有一个能快速纯化所有AAV血清型的平台,可以实现有效的空/全衣壳分离。” “这个平台不是采用昂贵的亲和层析,而是用正交化学的组合来达到所需的纯度和产量水平。”
BIA的收购还让Sartorius可以为研究者提供可靠的技术工具箱,去测量关键质量参数和性能属性。例如,BIA的CIMac分析柱是定量和通过指纹法获得样品全貌的有效工具。早些时候,Sartorius还收购了Danaher Life Sciences的FortéBio,其Octet平台可快速在线进行病毒滴度定量,来替代耗时的ELISA检测。
好的工艺需要适合于GMP生产,同时也需要标准化。随着悬浮生产工艺的优化和新的AAV纯化方法的涌现,这些期待有望尽快实现。
新的生产平台(New manufacturing platforms)
如若还做贴壁培养、用传统的细胞系和未经优化的单元操作(unit operations),开发者或CDMO就还要投入额外的时间去解决产量和效率的问题。说实话,即使是经验丰富的开发人员也倾向于依靠CDMOs来解决这些问题,并能把工艺带到商业规模。但是CDMOs的产能也是有限的,供需的瓶颈难以改变。而且不同开发人员有不同的工艺要求,也不见得一定能找到适合的CDMO。
MilliporeSigma公司的基因编辑和新模式负责人Angela Myers说:“我们正在用一种全面的方法来更高效地生产病毒载体。” “为了应对技术挑战,我们创建了VirusExpress慢病毒生产平台,结合高性能包装细胞系、化学成分限定的培养基和优化的悬浮工艺,可以提高上游操作的可放大性。
“随着对慢病毒和AAV生产模板化流程的开发,以及即将推出的AAV VirusExpress平台,我们正努力创建病毒载体生产的新标准。为了应对行业物流方面的挑战,公司最近投资了1.21亿美元,扩建了位于加州Carlsbad的病毒载体生产CDMO设施,该设施通过采用我们的产品技术,将能够更好、更快地生产病毒载体。” 新设施预计于2021年底投入使用,采用1000升的一次性生物反应器,可扩大规模和增加生产线,满足对高质量病毒载体日益增长的需求。
越来越多的人认识到过渡到悬浮培养的必要性,这表明行业内不仅认识到传统生产工艺中存在的挑战,而且也越来越关注于产量的商用规模和符合监管的要求。
此外,技术开发人员也正在开发专用的工具,以解决针对病毒载体特有的挑战。生物制剂商业化已有近三十年,人们都有一种强烈的愿望,要积极采用和吸取这其中的大量经验和教训。
克隆性的质控证据(Quality evidence of clonality)
单细胞克隆也是病毒载体生产中的必要阶段。Solentim全球营销经理Duncan Borthwick博士说:“克隆性(Clonality)涉及病毒生产工艺中的一个阶段,监管机构需要质控证据来证明工艺中的细胞基质来源于单个细胞,依此最小化细胞库的异质性和限制工艺的可变性。” “我们的技术用于确保生产细胞株的克隆性,并能提高细胞的生长率。”
Solentim的技术体现在该公司的VIPS和Cell Metric仪器上,通过单细胞铺板和捕捉图像来提供高质量的克隆性证据。据该公司称,这项技术已经是提交监管的克隆性证据的“金标”,如GSK,ThermoFisher和BrammerBio(2019年被ThermoFisher收购)等很多企业都已引进了该设备。

Solentim开发了VIPS(原位验证铺板)仪,用于单细胞克隆和基于图像的克隆性确证。在病毒载体生产的必要步骤-铺板时,VIPS可在极低的压力下将纳升级的细胞液滴铺入孔中,然后在孔底对进入干孔的每个细胞即时成像,克隆性的其他证据则通过也集成于VIPS中的Cell Metric功能或Cell Metric成像仪获得。
VIPS可在极低的压力下将纳升级液滴中的细胞分配到板孔中。每个细胞都在干孔的底部成像,作为铺板时证据。当培养基随后自动注满孔后,Cell Metric整孔细胞成象仪开始工作,并在第0天就进行图像处理,以确保双重保险的克隆性锁定。之后,每日成像继续确定分裂率是否符合是单个细胞起源的逻辑,来提供额外的证据。
应用Solentim技术可替代人工有限制稀释法和相关的统计推断,通过积累必要的数据,最终向监管机构提交可靠的克隆性证据。Borthwick说:“正确把握克隆阶段对于工艺工程是非常重要的。” “数据不足则会对开发时间表和监管审批带来很大的负面影响。”
Solentim的InstiGRO细胞生长添加剂能帮助更快速的细胞生长,帮助单个细胞度过“孤独的”克隆生长过程,给工艺流程带来积极影响。例如在GlaxoSmithKline的实际应用报告中,显示克隆生长提高了11倍。另一个产品InstiTHAW则有助于冻存和复苏过程中细胞活力的保持。
