相比其他方法,FIDA技术的主要优势:
在溶液中天然状态下详尽表征多肽-脂质体间的相互作用,可检测如:
– 结合亲和力(KD),
– 脂质体的大小(流体力学半径,nm),
– 相互作用的模式(竞争性FIDA分析);
此外,仅需微量样品,可实现无人值守自动化检测;内置有质量控制模块。
前言
本应用基于2020年一篇经同行评审的文献(1)。脂质体是一种模拟细胞膜结构的囊泡,是体外研究复杂膜相互作用的理想材料。本研究中,POPG脂质体作为神经元细胞膜的模型,来研究其与α-突触核蛋白(α-synuclein,αSN)的相互作用。α-突触核蛋白是一种小肽(140aa),与多种神经退行性疾病相关。
通常来说,详细表征这类膜相互作用需要一系列不同的分析方法,并且所能获得的信息也不多。在本报告中,我们展示了采用流动诱导分散分析法(FIDA)来表征α-synuclein和POPG脂质体之间的相互作用,可揭示结合亲和力(KD)、脂质体的大小(流体力学半径,size)以及相互作用的机制(1)。
FIDA是一种基于毛细管的新技术,利用泰勒色散原理在压力驱动的流体中精确测定分析物的粒径(流体力学半径)大小(2),来测定溶液中自然条件下生物分子间的结合亲和力和形成的复合物的大小(2-5)。
材料和方法
使用FIDA标准毛细管(内径:75µm,LT:100 cm,Leff:84 cm),在FIDA-1仪器上用488nm激光诱导荧光检测。样品分析:先用4µL POPG脂质体溶液填充毛细管,然后注射入39 nL和POPG脂质体一起预孵育的αSNY133C-Alexa488,,在100mbar,21°C,pH 7.4条件下随POPG脂质体溶液一起向检测器移动。在固定浓度的αSNY133C-alex488(200nM)条件下对不同浓度的POPG脂质体进行亲和性测定(0-200µM)。竞争性实验:将不同浓度的竞争物加入固定浓度的αSNY133C-Alexa488-脂质体复合物中,使用专用的FIDA软件进行数据分析。
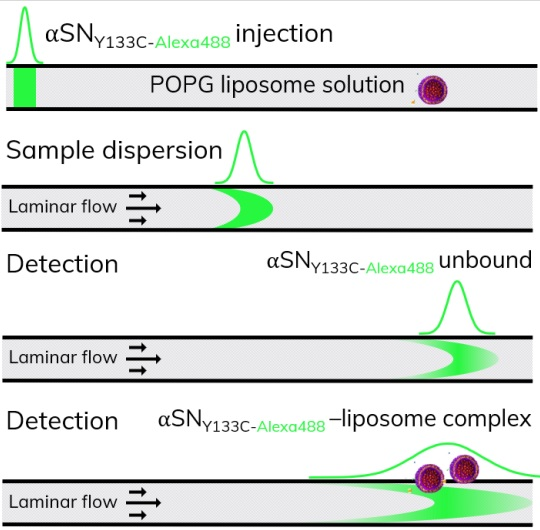
图1:FIDA检测原理示意。40 nL的指示剂α-突触核蛋白(在c-末端标记上alexa488)在层流条件(laminar flow)下进入毛细管。指示剂将按其分子大小的比例分散。利用该原理可精确测定游离指示剂的粒径(流体力学半径),以及指示剂与脂质体结合后复合物的的粒径。
结合亲和力(KD)和脂质体大小(size)
FIDA技术可测量特定结合物(αSN)与感兴趣的分析物(POPG脂质体)相互作用时的分子大小(Rh,Hydrodynamic Radius,流体力学半径)的绝对值。测得的αSN的Rh为3.2nm,与有关文献一致(6)。
αSN的表观大小随着POPG浓度的不断增加而逐步增大,直至约27nm,显示与更大的颗粒发生了相互作用,见图2。各数据点拟合为FIDA结合等温线(binding isotherm),假设结合化学计量比为1:1,可导出相互作用的平衡解离常数(KD)为2.5µM。此外,复合物的Rh可确定为28.5nm,从而揭示了POPG脂质体的平均半径。
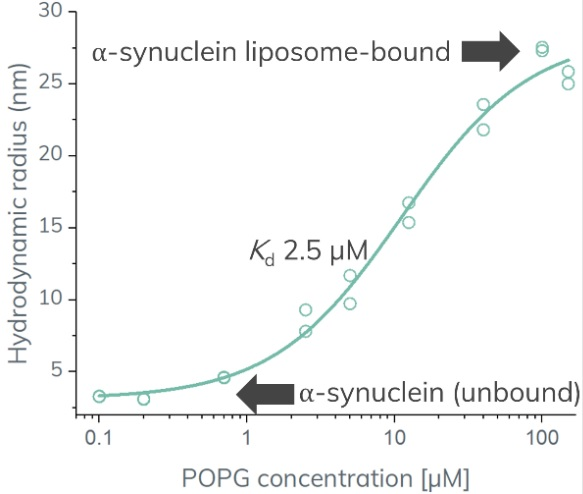
图2:FIDA结合曲线。αSN的表观大小与POPG脂质体浓度的关系。数据点拟合为FIDA结合等温线,以确定KD和脂质体的粒径大小。
相互作用的模式
相互作用的模式通过一系列竞争性FIDA分析进行评估,四种不同的αSN类似物与之前图2所示的测定方法进行对比。具体而言,将图2中形成完整结合复合物时的条件作为初始状态(100µM POPG,0.2µM αSN),通过滴定实验测定四种αSN类似物的竞争结合能力,得到IC50值。
我们发现野生型αSN(蓝线)和N-乙酰化-αSN(黑线)能够完全置换结合脂质体的αSN,见图3。根据FIDA结合等温线计算N-乙酰化-αSN和野生型αSN的抑制浓度(IC50),分别为0.3µM和0.5µM,和所用的指示剂(αSN)浓度0.2µM相当。另一个类似物αSNΔ1-14(橙色线,N端缺失了前14个氨基酸),就不能完全取代脂质体结合的αSN,可见表观亲和力显著下降,有几个数量级的变化。最后,N端片段P1-14则完全不能置换与脂质体结合的αSN,在整个滴定过程中观察到其Rh大小保持稳定(蓝色三角形)。综上所述可见,N末端残基1-14的保留对膜相互作用至关重要,然而N端残基本身却并不能与脂质体膜相结合,显示出一种依赖于亲和性的复杂作用模式。
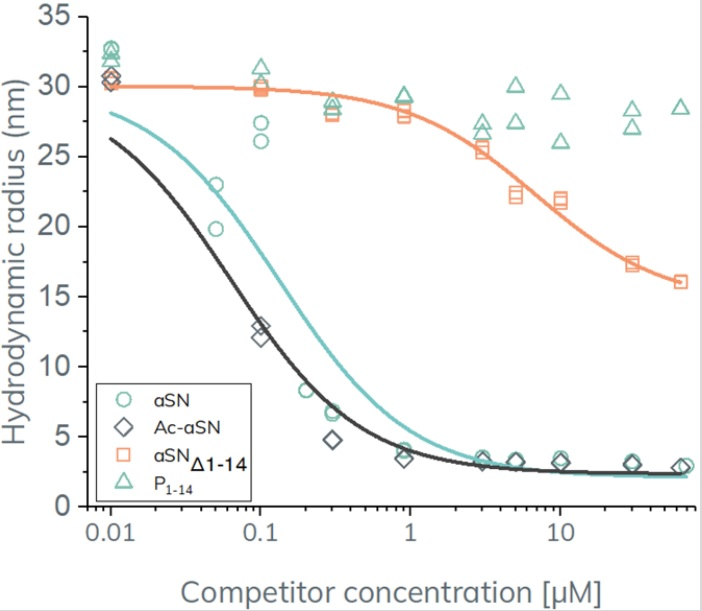
图3:FIDA竞争分析。脂质体结合αSN(100μMPOPG和0.2µMαSN)的大小有四种不同αSN类似物的函数。数据点与FIDA结合等温线拟合以确定IC50值。
结论
FIDA可用于检测α-synuclein与POPG脂质体在溶液中的相互作用,准确地测定结合亲和力(KD)、复合物的流体力学半径的大小,以及相互作用的模式。该方法可以很容易地应用于其他囊泡物如外泌体的分析。最后,FIDA与传统方法相比有许多优势,如低样品消耗(几微升)、自动化平台、分子绝对大小的测量,内置质量控制模块,在溶液中自然状态下进行分析等。
